
田辺三菱製薬におけるデータ駆動型創薬の取り組み
2023.09.20
創薬研究者による「KIBIT Amanogawaを活用した仮説生成の事例」
2023.12.19
遺伝子の機能喪失型変異に起因する疾患は数多く存在します。この場合、タンパク質は機能を喪失しており、タンパク質そのものに対する治療介入は通常困難を伴います。機能喪失型変異を有する遺伝子に加えて、別の遺伝子に対して、同時に変異を起こすことで疾患あるいは症状が抑制される現象が知られています。この別の遺伝子 (サプレッサー遺伝子)は治療標的として期待されますが、そのような遺伝子を実験的に見出すにはコスト的、時間的負担が大きく、現実的ではありませんでした。FRONTEOが「Drug Discovery AI Factory」によって実現した、サプレッサー遺伝子を効率的に抽出するためのアプローチを事例と共に紹介していきます。

Speaker
株式会社FRONTEO
ライフサイエンスAI事業本部
ライフサイエンスAI研究チーム 部長
博士(農学)
宮本 実
京都大学大学院卒業後、武田薬品工業株式会社に入社。新薬開発の初期から後期までの前臨床安全性評価、特殊毒性(光毒性)評価、毒性機序解明、安全性バイオマーカー探索など幅広く従事
機能喪失型変異に起因した疾患に対する新しい標的探索法の紹介、サプレッサー遺伝子の効率的な抽出方法について説明していきます。
機能喪失型変異に起因する疾患
機能喪失型変異に起因する疾患に対する我々のソリューションに関してお話しします。
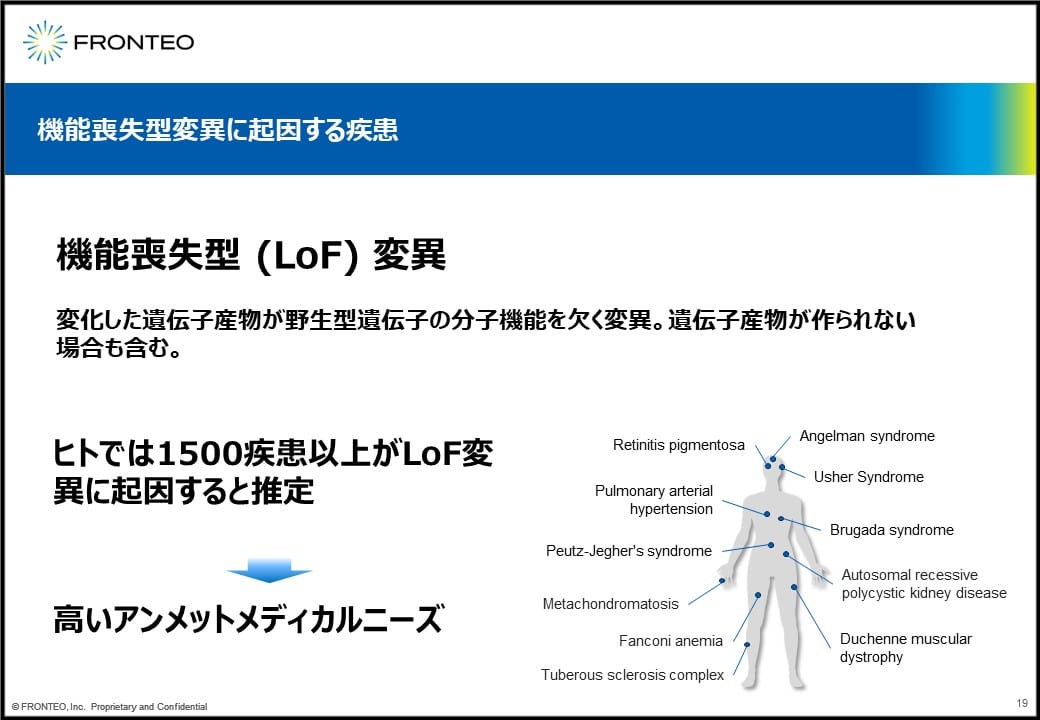
機能喪失型変異がどういうものかというと、変化した遺伝子産物が野生型遺伝子の分子機能を欠く変異で、遺伝子産物が作られない場合も含みます。現在、ヒトでは1,500疾患以上が機能喪失型変異に起因すると推定されていて、全身でいろいろな疾患が起こるということも分かっています。良い治療薬が見出されていませんので、非常に高いアンメットメディカルニーズが存在します。
機能喪失型変異に起因する疾患の創薬は難しい
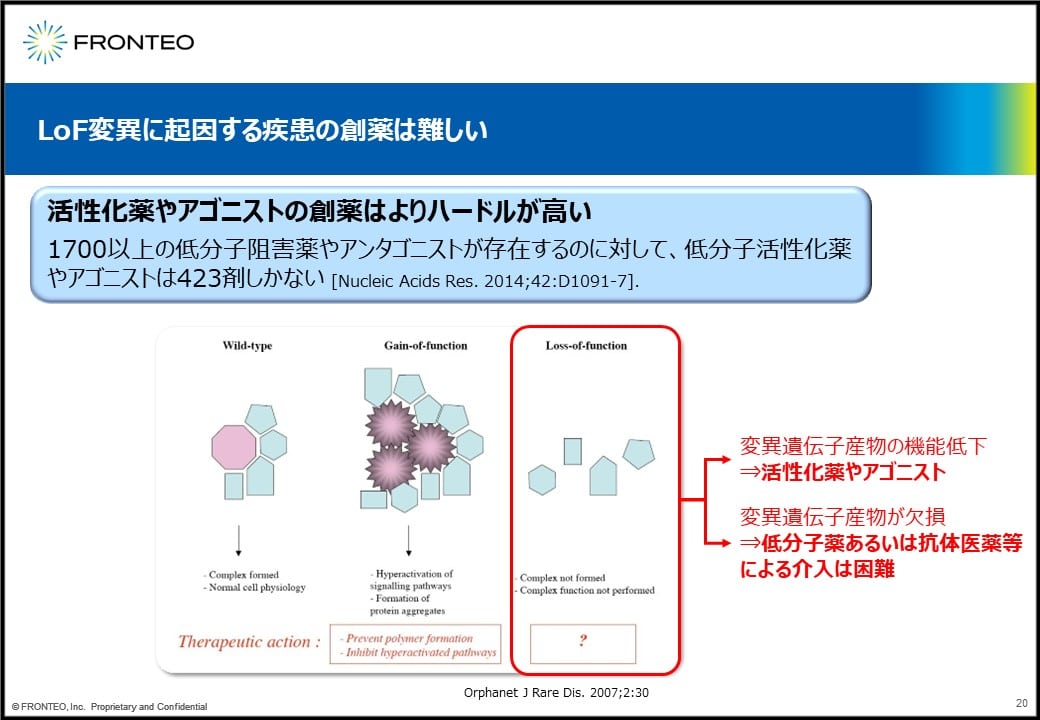
この機能喪失型変異に対して創薬をしたいと考えた場合、活性化薬やアゴニストの創薬は非常にハードルが高いと言われています。1700以上の低分子阻害薬やアンタゴニストが存在するのに対して、低分子活性化薬やアゴニストは423しかないと言われていて、なかなか難しいということがわかります。
変異に対してどういう治療介入が可能かということが示されているのがスライドの下の図です。機能喪失型変異の場合、変異遺伝子産物の機能低下があるので活性化したい、でも活性化薬やアゴニストは非常に難しい。産物自体がもうない場合も、低分子薬あるいは抗体医薬で介入するのは困難ということになります。
解決策のひとつとしてサプレッサー遺伝子に注目
ではどうすればいいか?ひとつの解決法としてサプレッサー遺伝子に注目します。
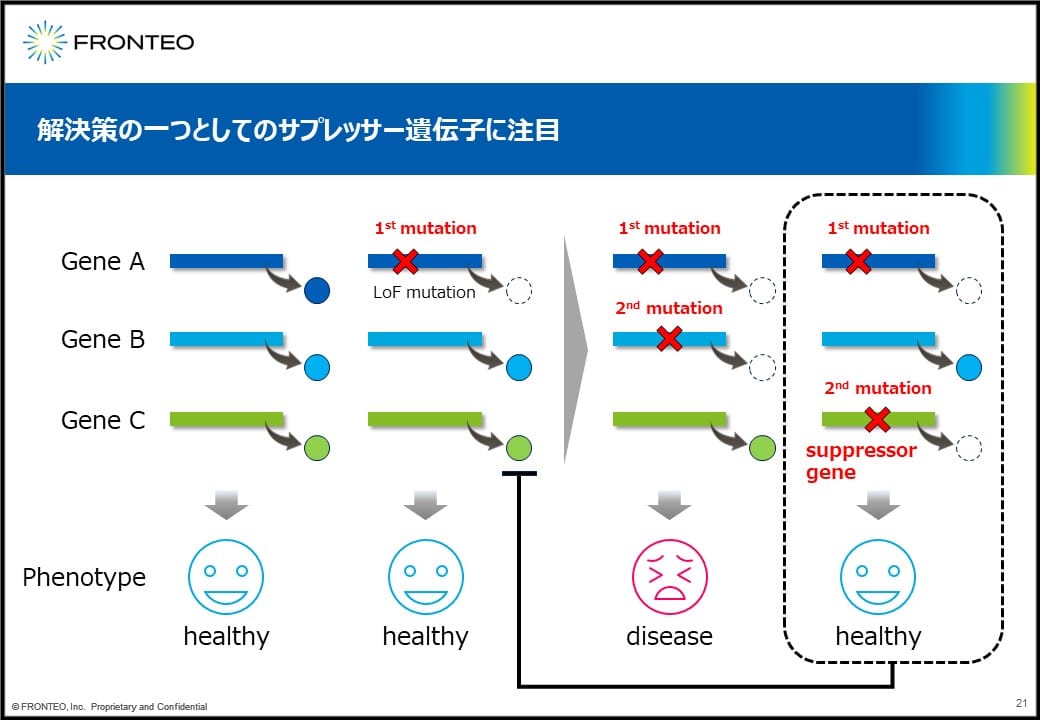
例えば遺伝子A、B、Cがあって、それぞれタンパク質が作られるとします。この場合は正常ですが、遺伝子Aに機能喪失型変異が入ってタンパク質ができなくなり、疾患になるという状況があったとします。
遺伝子Bにも変異が入ったとして、多くの場合、疾患が治るということはないですが、場合によって遺伝子Cに変異が入ると回復するというケースがあります。
この場合、遺伝子Cはサプレッサー遺伝子と考えられますので、遺伝子Cの産物を抑えることによって回復するということが期待されます。
ではこのサプレッサー遺伝子を探せばいいということになりますが、現在のアプローチだとなかなか難しいです。
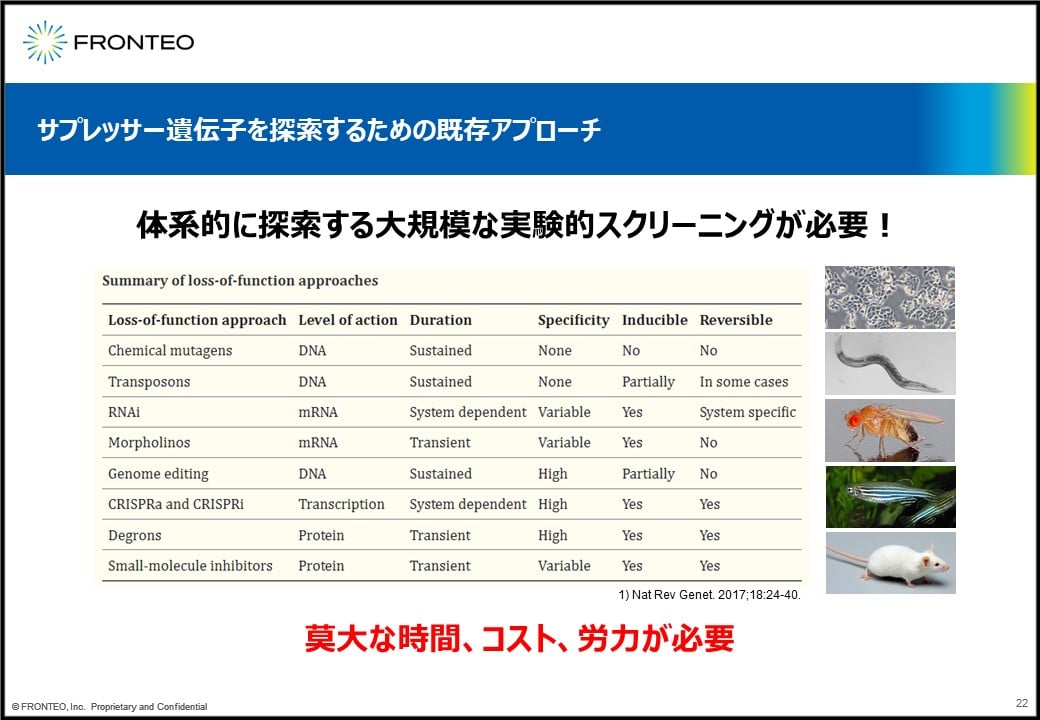
サプレッサー遺伝子を体系的に探索しようと思うと、非常に大規模な実験的スクリーニングを行わなくてはならないので、莫大な時間とコストと労力が必要になります。
サプレッサー変異遺伝子の効率的な抽出方法
独自の疾患ネットワークの活用
これに対して我々のソリューションとして、独自の遺伝子ネットワークの活用という方法を考えています。
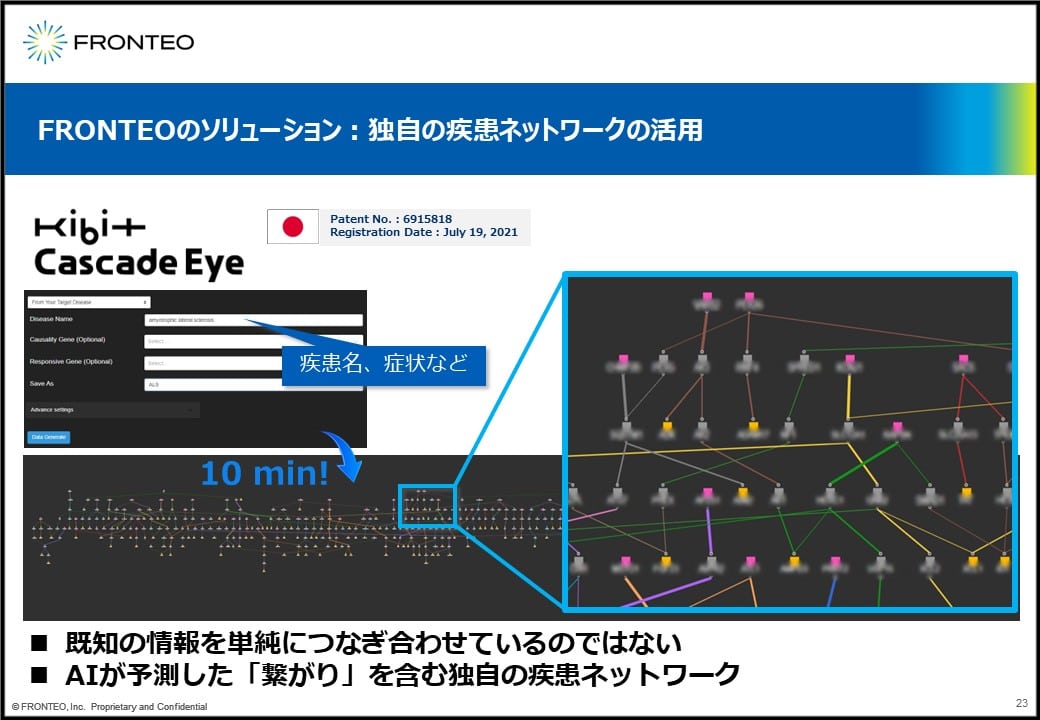
独自のアルゴリズムにより、疾患名や症状などを入れると約10分でネットワークが描けます。
独自のアルゴリズムに基づくユニークな遺伝子ネットワーク
これは既知の情報を単純につなげ合わせたものではなくて、AI「KIBIT」が予測した繋がりを含む独自の遺伝子ネットワークです。
・事例1 NGLY1欠損症
事例として、NGLY1の欠損症を挙げてみたいと思います。

NGLY1は細胞内の糖タンパク質からN型の糖鎖を除去する酵素です。これが欠損しますと神経機能の障害というものが出てきます。非常にウルトラレアではありますけど、現時点でこの疾患に対する治療薬はありません。動物モデルとしてマウスとラットがありますが、マウスの場合は胚性致死になってしまいます。

これに関して、2021年にPNASでNGLY1欠損におけるこの細胞障害のメカニズムが報告されています。これはNGLY1欠損細胞において、FBS2が発現しているとユビキチン鎖が過剰についた異常な糖タンパク質が細胞内に蓄積して、細胞が死んでしまうというものです。
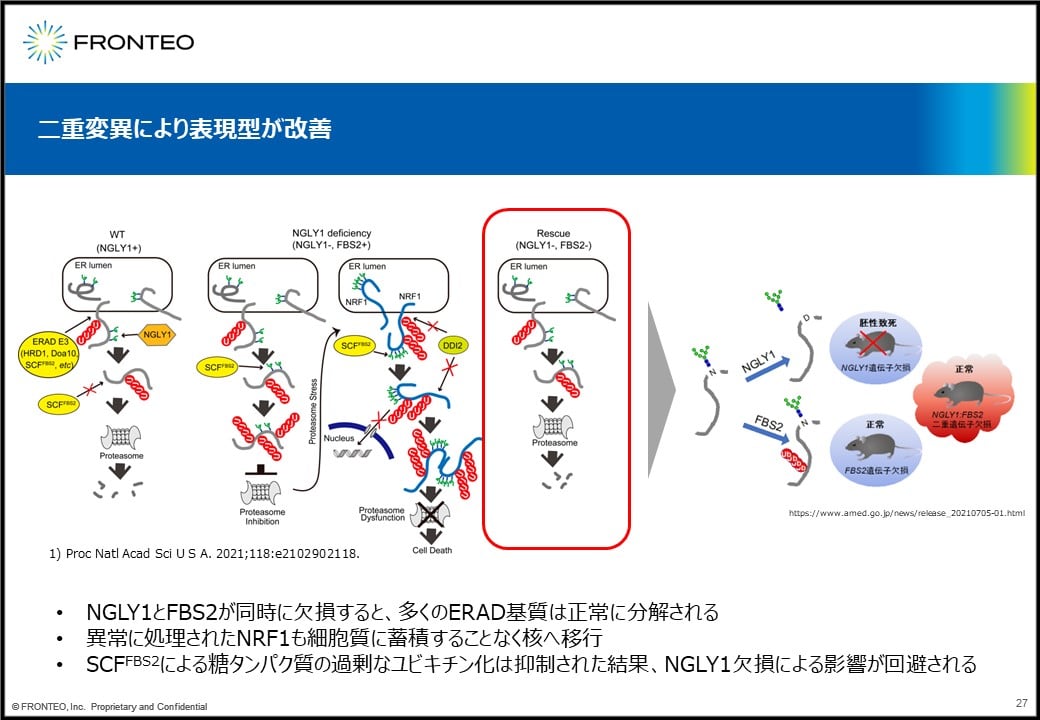
これに対してFBS2も同時にノックアウトすると、NGLY1単独だと胚性致死になってしまうのが正常に生まれることから、FBS2はサプレッサー遺伝子と考えられます。
NGLY1と相互作用するタンパク質は多いので、詳細なメカニズムが分かっていないとサプレッサー遺伝子を見つけるのはなかなか難しいと考えられます。
我々はPNASの報告がある前に、KIBITを使ってNGLY1からネットワークを描くことでFBS2がちゃんとNGLY1の下流に存在するということを見出していました。
・事例2 レット症候群

乳児における急激な発達退行が見られる重篤な症候群ですが、原因はメチル化DNAに結合する染色体タンパク質であるMECP2という分子です。レット症候群の患者さんの95%以上でMECP2に変異が見られていて、動物モデルも存在しています。
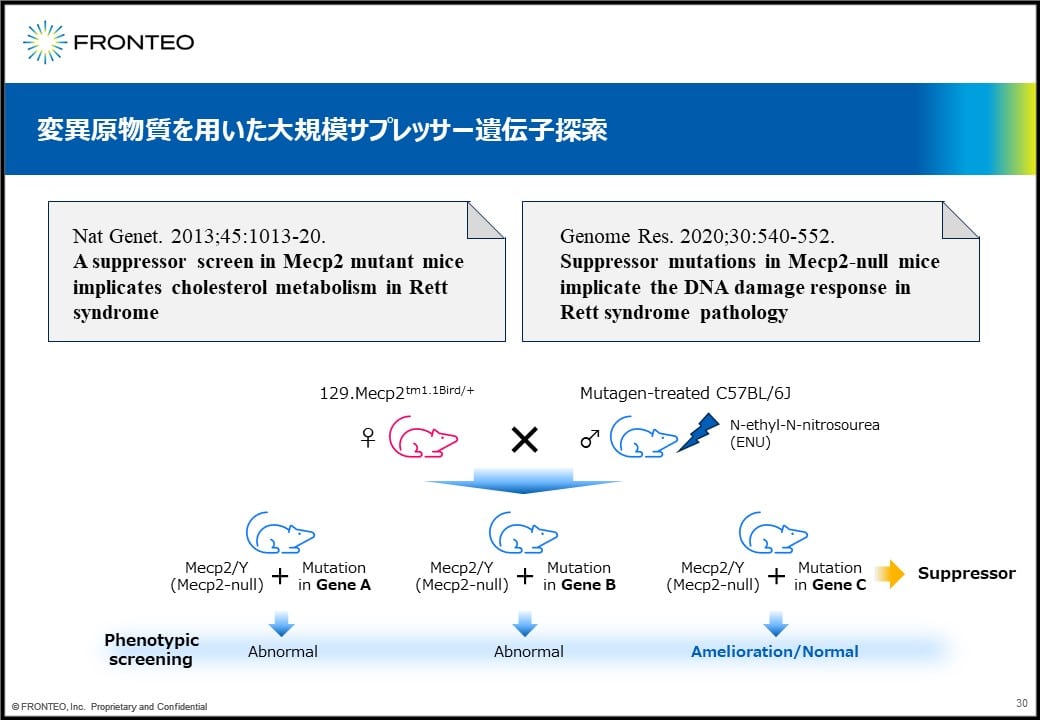
これに関して非常に大規模な実験が報告されています。変異原物質を用いて大規模にサプレッサー遺伝子を探索するというものです。メスのMECP2欠損マウスと、変異原物質でランダムに遺伝子変異を起こしたオスを交配して、出てきた子どもたちのPhenotypeを見ていくというものです。
例えば表現型が回復したマウスの遺伝子を調べていき、このように遺伝子Cがノックアウトされていたとすると、遺伝子Cがサプレッサー遺伝子だと判明する形です。この論文の中だと、これだけのサプレッサー遺伝子が見出されています。
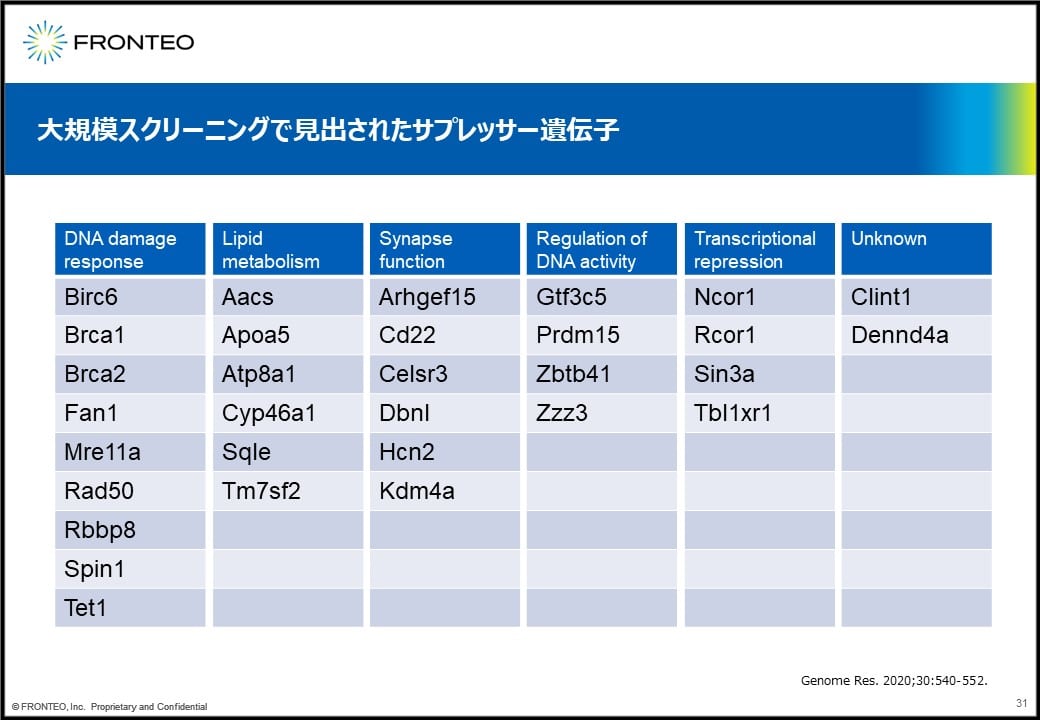
我々もレット症候群に対してMECP2に関連する遺伝子ネットワークを描いてみました。すると、実験的に示されたサプレッサー遺伝子の一部がしっかりと含まれていることを確認しています。
これが10分で描けるわけです。さらにこのMECP2との繋がりについても、並べ替えると上位にサプレッサー遺伝子が入ってくるということを見出していて、優先順位付けも可能だと考えています。
最後にまとめです。機能喪失型変異に起因する疾患に対する創薬を目指す場合、この遺伝子に直接作用する低分子を目指すというのはなかなか難しいです。
ではサプレッサー遺伝子を狙えばいいということになりますが、今度はサプレッサー遺伝子をどう見出すかというところが難しくなります。既存のアプローチだと、サプレッサー遺伝子を体系的に探索する大規模なスクリーニングをしなければならないため、膨大な時間とコストが必要になるからです。
それに対して、我々はKIBITを使って、ユニークな疾患ネットワークによるサプレッサー遺伝子候補の効率的な抽出が可能なので、最低限のウェット実験で生産性の高い遺伝子探索ができます。
創薬の始まりは仮説生成
創薬の始まりは仮説生成だと我々は考えています。

それには、仮説の新規性が重要です。AIが人の想像を超えたヒントを提示してそれを研究者が経験と知識を活かしてfeasibleな仮説に昇華すること。それに加えて、仮説のクオリティです。単に候補遺伝子や適応症候補のリストを提案するのではなくて、今すぐにプロジェクト提案ができるレベルの仮説を作ること。これによって、創薬研究の加速化・効率化、成功確率の向上に貢献していこうと考えています。












