
ひらめきを増やし、発見につなげる KIBIT Amanogawa
2023.08.22
「Virtual Experiments」~標的遺伝子をノックアウトした世界を生成する~
2023.09.04
FRONTEOは、新規性の高い標的分子の選定とその仮説生成からAIを活用する「Drug Discovery AI Factory」構想を掲げ、創薬研究にイノベーションを起こします。この「Drug Discovery AI Factory」構想の責任者、理学博士・豊柴博義氏が目指す創薬の世界、現状のFRONTEOの創薬に対する取り組みを語りました。

株式会社FRONTEO
取締役/CTO
博士(理学)
豊柴 博義
早稲田大学大学院 理工学研究科数学専攻修了後、米国国立環境健康科学研究所等で、さまざまなデータの統計解析を用いた研究に従事。2017年よりFRONTEOでライフサイエンスAIの開発に従事。ライフサイエンスの領域に特化したAIアルゴリズムを開発。テキストのベクトル化という特徴を生かし、現在までに論文探索、創薬支援、認知症診断支援、転倒予測などのさまざまなビジネスをこのアルゴリズムをベースに開発している。2019年よりライフサイエンスAI CTO。2021年には執行役員に就任。AIの社会実装を更に推進する。
今の創薬の主流は「First in class」
私からは創薬支援サービス「Drug Discovery AI Factory」を中心にお話しさせていただきます。まず創薬分野で勝ち抜くためには、2つの重要な要素があると考えています。
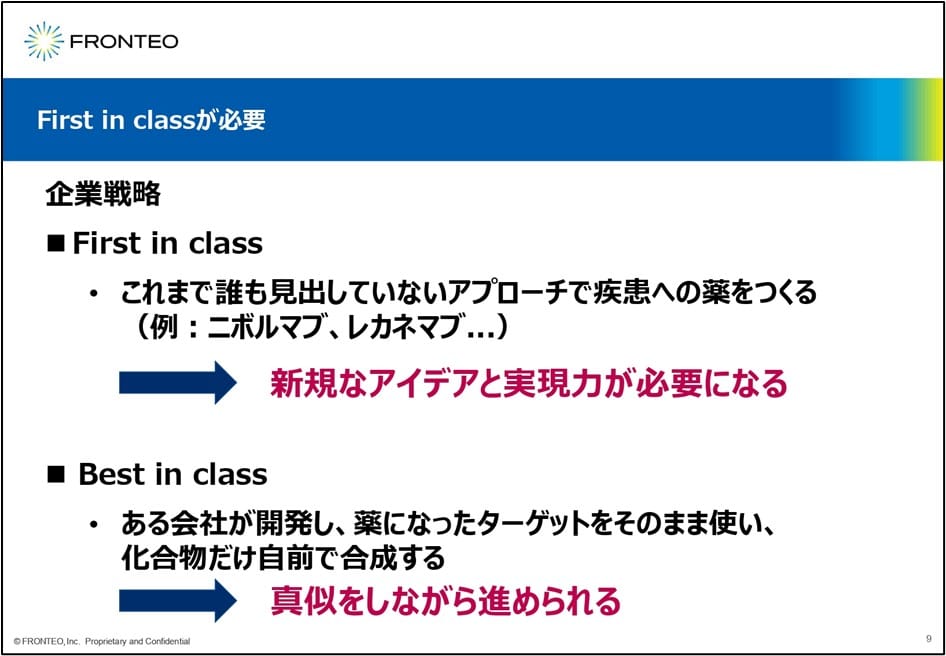
1つ目の重要な要素はFirst in class(従来にないアプローチで薬を創る)です。企業戦略としてFirst in classでないと、なかなか上市できなくなってきています。ただFirst in classを目指そうとすると、新しいアイデアとそれを実現する力が必要になります。
ひと昔前まで日本の製薬会社の多くは、Best in class(Fist in classの化合物の構造からさらに薬効が高く毒性の低い候補化合物を探す)で、薬を開発していました。Best in classは先行品があるので、ある程度“マネ”をしながら進められますが、今の主流であるFirst in classの場合は、新しいアイデアが必要になります。
疾患との関連性が少ない標的分子の提案は困難
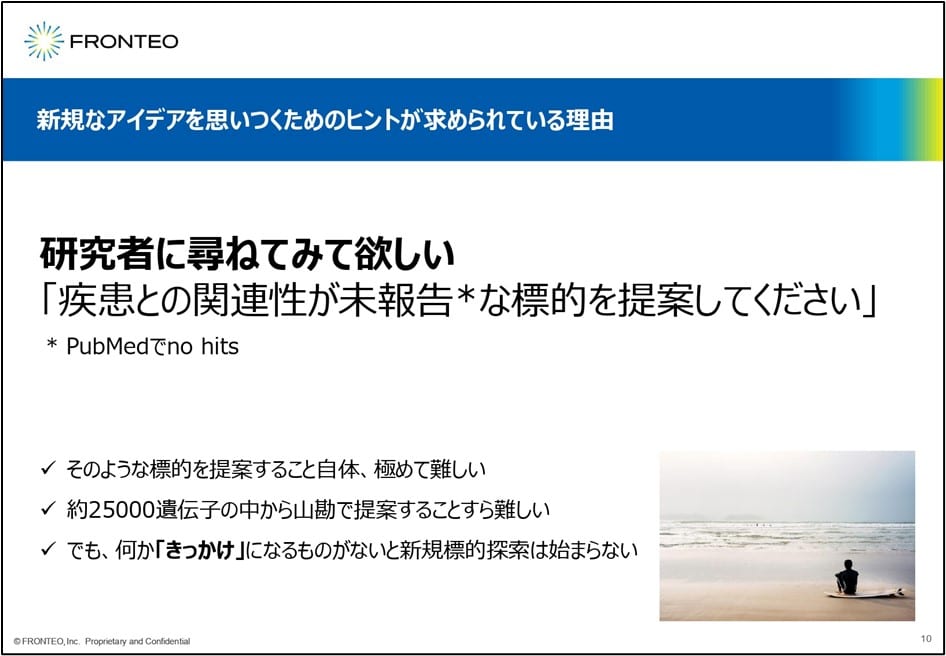
新しいアイデアは、出そうと思って出せるものではありません。実際に疾患との関連性がほとんどない標的を提案するのは非常に難しい作業です。実際私が見つけようと思っても 、1つとか2つとか自分が見てきたような分子しか思い出すことができないのが正直なところ。First in classに必要な「新しいアイデアを出す」というのは、極めて困難です。
AIを活用した創薬ターゲットの選定
2つ目の重要な要素は 「数」です 。こちらにあげた24.3という数字は、1年に少なくとも1つの新薬を出すために必要なプロジェクト数を指しています。 1年は約50週あるので 24.3で割ると1カ月に2つ、2週間に1つということになります。このペースで、新規標的が必要だということです。

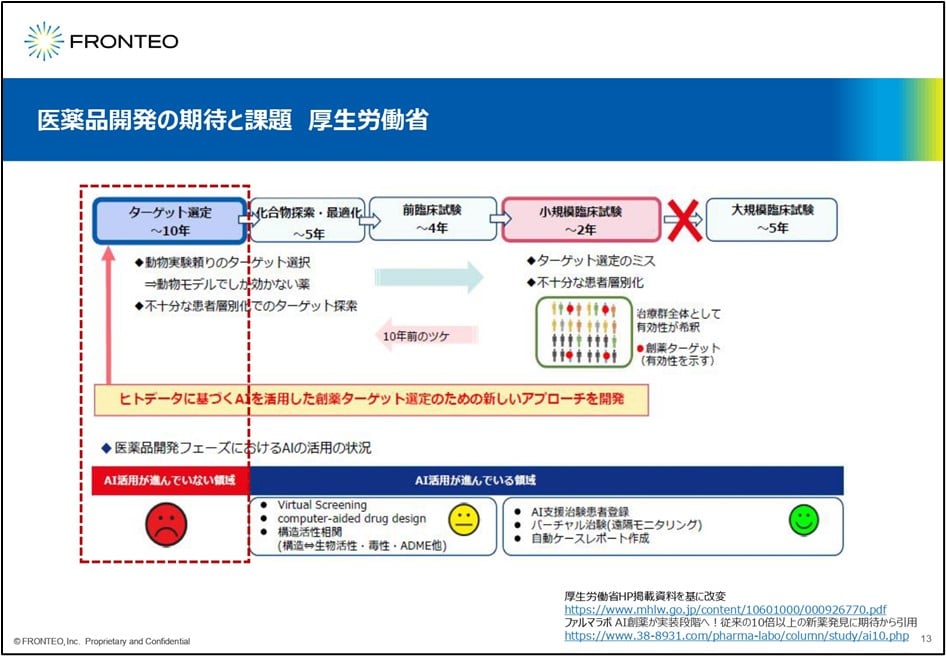
ではこの24.3を創り上げるのに、何が必要か?ということになります 。これは、厚生労働省が出している資料になりますが、ここにもヒトデータに基づく「AIを活用した 創薬ターゲットの選定」が必要だろうと謳われています。
肝心なパートでAIが活用できていない
こちらの黄色のマークの部分は割とAIが使われている部分です。バーチャルスクリーニング、それから化合物の合成だったり最適化であったり、そういう部分についてはある程度AIが使われています。
一番右側の臨床試験の部分についてはかなりAIの活用が進んでいるということで、青い笑顔のマークになっています。けれども 、先ほどから話題にあがっている創薬プロセスで重要な部分はいちばん左。このターゲットの選定の部分でAIがなかなか使えていない、というのが現実です。
新規性の高い標的分子選定と仮説生成
FRONTEOは、特に最初のアイデアの着想や標的分子探索・選定のフェーズでAIを活用し、事業を進めたいと考えています。このフェーズでキーとなるのが新規性の高い標的分子選定とその仮説生成です。研究者がある標的分子について考察する場合、自分が読んだ文献の情報をベースに考えてしまいますが、KIBITはPubMed*に収載された3000万報の文献情報から、網羅的かつアンバイアスに解析することが可能です。
さらにKIBITは、論文に直接記載がなくても、ある疾患に関連する遺伝子と似た機能や位置づけの遺伝子が異なる論文に記載されていれば、ちょうど研究者が推察するのと同じように疾患との関連を予測し、その疾患とつなげてくれて、遺伝子発現解析やGWASなどの既存のアプローチでは見つけられなかった新規性の高い標的分子を見つけることが可能となります。
*米国国立医学図書館 国立生物科学情報センターが運営する生物医学領域論文データベース
Springer Nature(シュプリンガー・ネイチャー)との協業
PubMedの約3000万報のアブストラクトに加えて、Springer Natureの最先端かつ多様な分野の論文の"フルテキストデータ"も解析することが可能となりました。これにより、解析の精度と効率がさらに向上し、領域をまたいだ論文の解析などでイノベーションを導きます。PubMedに基づくコーパスを維持しつつSpringer Natureに基づくコーパスを融合できるという、独自技術によって実現しています(特許取得済み)。

創薬のポイントは「仮説生成」

AIと創薬に精通した研究者の必要性
私も前職で様々なデータを扱ってきましたが、ここから出てくるデータは基本的には「リスト」になることがほとんど。例えば遺伝子であったり化合物であったり、そういう関連するリストが出てきます。
しかしながら、新規性の高い標的分子のリストがあったとしても、仮説がなければ創薬プロセスを進めることは非常に困難です。仮説である疾患メカニズムを推定するには、一般的に研究者が膨大な論文を読み込む必要があります。仮説生成に強みを持つDrug Discovery AI Factory では、AIと創薬に精通した当社の創薬研究者がKIBITを活用して、疾患メカニズムである仮説を短期間で生成します。
この24.3という数字をしっかり継続して出していくためには、 継続的に新規性の高い検証可能な仮説を出すことが重要だと思っています。そこで我々はAIを使った異なるアプローチを提案したいと考えているのです。
分散表現を使った自然言語処理が得意なAI
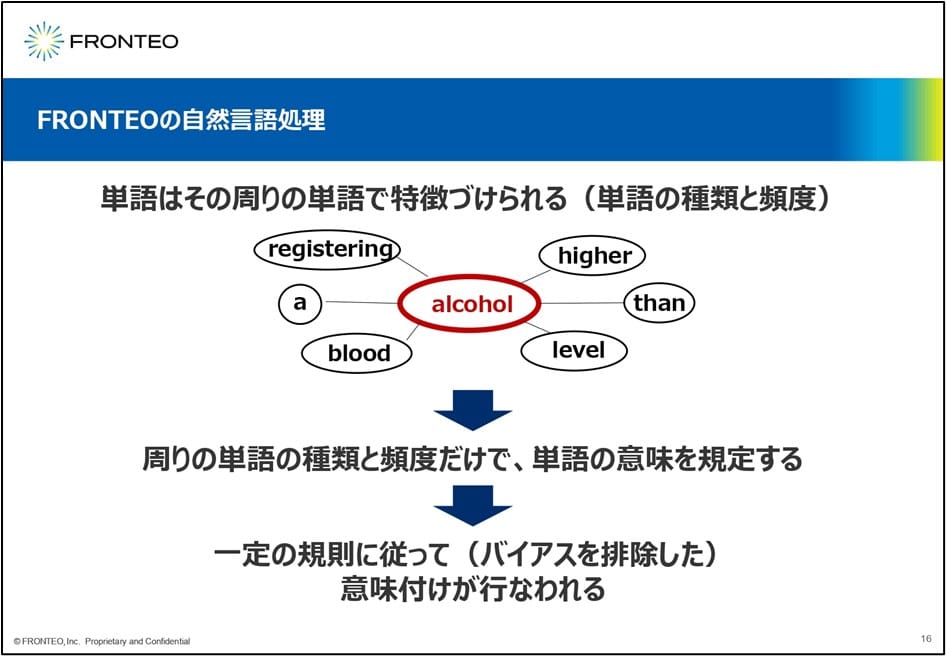
まず我々のAIの特徴として 、自然言語処理が非常に得意という点があります。その中でも 分散表現と呼ばれる手法を根底で使っています。
その根底になっている理論は、単語はその周りの単語で特徴付けられるというシンプルな法則に従っています 。ここにあるように「アルコール」という単語を人工知能に認識させているわけではないのです。
アルコールの周りに出てくる単語とその種類と頻度を持って、AIはこのアルコールという単語を認識しているという形になります 。ですから我々のエンジンの場合は、2つの単語が似たような意味だと判断するのは、周りに出てくる単語の種類とその頻度が似ているから、ということになります。この一定の規則に従って我々のAIは 、文章の近さや単語の近さを評価していきます 。
AIが出す「アンバイアスな結果」が大切
顧客の中には、当社のAIを使って「ノイズが上がってきました」と言われる方がまれにいらっしゃいます。けれども、基本的に当社のAIはアルゴリズム上、ノイズが上がってくることはありません。
我々がノイズと感じるのは、想定している単語の意味が、非常に限定的になっているから。つまり、いままで読んできた文献以上で意味づけられる単語の概念を、我々がイメージできていない、と考えてください。

ノイズと感じる結果がイノベーションにつながる
このアンバイアスな、いわゆる一定のルールに従った意味付けが、非常に重要になってきます。イノベーションは「意図的な偶然」と「異分野の融合」でもたらされるとよく言われますが、我々のAIが出してくるこのアンバイアスな結果、先ほど話した「ノイズではないかと感じるもの」自体が、「意図的な偶然」と新たなつながりの始まり(異分野の融合)ではないかなと思っています 。
我々のAIは、このような形でなかなか気づかないところにアプローチしてくれるツールとして使おうと考えています。ではなぜそこに創薬研究者が必要なのでしょう?
AIと研究者の融合で「新たな仮説生成」を実現
エジソンの有名な話で、 電球を発明した際にフィラメントという部分に何の物質を使ったらいいか非常に悩んだというエピソードがあります。最終的には偶然机の上にあった竹の扇子を見て、この竹をフィラメントに使ったらどうかと思いついたわけです。
我々の AIが出してくる「新たなつながり」を、これまでの知見やこれまでの創薬研究と結び付けようとすると、この竹とフィラメントと同じように、やはり専門的にやってきた人じゃないと難しいんじゃないかと思っています。
そこで、我々のAIと研究者を融合させたような形で「新たな仮説生成」を行っていきたいと考えています。

私も前職でずっと創薬研究に携わってきましたし、ほかの研究者たちも、製薬会社で長年にわたって創薬研究に携わってきました。このような研究者とAIを融合して、新しい仮説生成を行っていきたいと考えております。

AI×創薬研究者が生み出したBest Known Methods
自社開発のAIと我々の創薬研究者が編み出した方法が、Best Known Methodsという5つの手法になります。
これは単に、AIをずっとやってきた研究者が創薬研究にも使えるだろうということで開発したのではなくて、実際に創薬研究をやられた方が、我々のAIをどんな風に使えば創薬研究に役立つかという観点で作っていますので、非常に有用な手法だと思っています 。

この一番右に上げているVirtual Experiments。これはネットワークのような形で疾患と分子とのつながりを表現しています。その中の1つの分子をノックアウト。その後に出てくるパスウェイを分析します。例えばこのパスウェイがなくなった場合に、代わりにどんなものが出てくるのかを見ながら、新しい標的分子を選定しています。
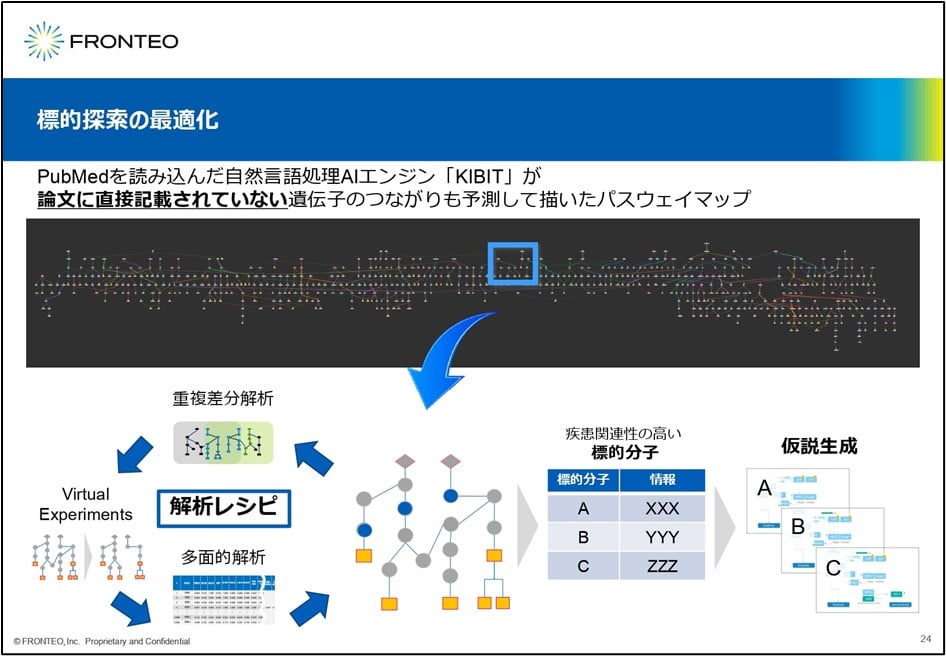
論文にない遺伝子のつながりも予測
我々のAIの場合、疾患名の名前を入れると、10分ほどで、このように約700の標的分子ネットワーク図を示してくれます。
この中でAIが論文に直接記載されていない遺伝子のつながりも予測して作ってくれます。我々の研究者はそのネットワークの中で注目した部分について、Best Known Methodsの5つの手法を組み合わせた解析レシピでどの標的分子が最も興味深いかというのを上げていきます。
この青い印の部分(青丸)がそれに相当すると見てください。この分子については、いろんなファンクションであったり、その分子が持っている性質であったりを見ますけれども、当社の創薬研究者はそれを最終的に仮説まで持っていきます。これが、我々のAI創薬の特徴だと思っています。
質と量を担保した創薬支援を実現
最後にこれまでの実績を紹介します。 我々は受託をベースに20以上の案件に取り組みました。

上の表にあるように、FRONTEOの創薬支援サービスは、標的探索から適応症の探索、薬剤併用、バイオマーカー探索までカバーします。
我々が提案した標的分子の中の30以上がすでにVitro (細胞の実験)に進み、その有効性が示されたと聞きました。5つ以上はVivo(動物の実験)まで進んでいます。我々のAIと研究者の掛け合わせで出てきたものが、アウトプットにつながっています。
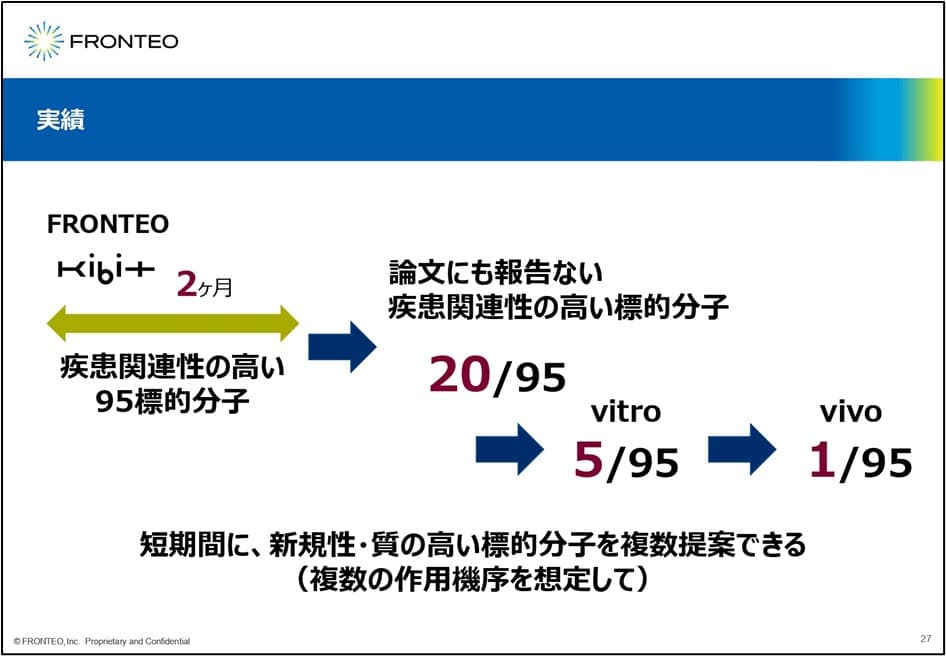
約100の標的分子をノミネート
こちらが最新の結果です。冒頭にFirst in classとお話ししましたが、2カ月ほどでこのネットワークを使った分析で約100の標的分子をノミネートしました。さらにこのプロジェクトは非常にチャレンジングで 、この100の中からさらに未報告の20の疾患関連性の高い標的分子を抽出しました。
提案した20の標的分子は、実際にvitroで検討し、5つが表現型を示し、1つは vivoまで進んだと聞きました。
新規性の高い、質の高い標的分子をパスウェイを見ながら出していきます。単に上下につながっているだけではなくて、そのパスウェイへどういうところから選んできたかと我々の方では異なるメカニズムであるかどうかも含め認識しながら提案します。
また2カ月という非常に短い時間で、未報告の5つの標的分子を選定するのも今までにないアプローチで解析した結果だと思っています。

たった2カ月で、5つの標的分子を発見
現在の創薬には「First in class」が必要です。この20個の標的分子は疾患とのつながりが論文に直接記載のない分子ということで、非常に新規性が高いものが出せました 。
次に上市するのに必要な24.3標的分子の量的な部分。こちらも2カ月という短い期間で20個のうち5つが表現型を示しました。
2カ月に5つですので、1カ月あたり2.5個。一番最初に出した目標の24.3個は1カ月に2個以上なので、質と量を担保した創薬支援を実現できたと考えています。











