
機能喪失型変異に起因した疾患に対する新しい標的探索法の紹介~サプレッサー変異遺伝子の効率的な抽出方法~
2023.10.18
創薬研究者による「KIBIT Amanogawaを活用した仮説生成の事例」
2023.12.19
創薬標的候補分子の機能を評価する手段として、遺伝子ノックアウトなどの実験的解析手法があります。しかしながら、疾患モデルでの評価や多くの遺伝子の実験的な評価は簡単には実施できないことが課題となります。本課題を解決する手法として、弊社独自の自然言語AIエンジンで作成した疾患ネットワークから仮想的に目的遺伝子を論文上で消失させ、新たに疾患ネットワークを再構築させることにより、遺伝子ノックアウト後の疾患状態を予測する独自の解析手法「Virtual Experiments」を開発しました。抗がん剤抵抗性の課題を例にVirtual Experimentsを活用したソリューションをご紹介いたします。

Speaker
株式会社FRONTEO
ライフサイエンスAI事業本部
ライフサイエンスAI研究チーム
担当部長 博士(理学)
三上 寿幸
早稲田大学、東京工業大学大学院卒業後、住友化学株式会社に入社。創薬基盤技術開発、創薬探索。また、ゲノム科学研究所にて最先端ゲノム関連技術を用いた創薬研究に従事。現在、オンコロジー領域のAI創薬およびAI解析業務をリード。
「Virtual Experiments 〜標的遺伝子をノックアウトした世界を生成する〜」についてお話しします。

最初に基本的な技術の概要、次にVirtual Experimentsについて、そして最後に応用例として抗がん剤抵抗性の話をしたいと思います。
Drug Discovery Best Known Methods
自然言語AIを活用した疾患ネットワーク作成
こちらの図は、我々が使用しているネットワークの作成の原理を示したものです。
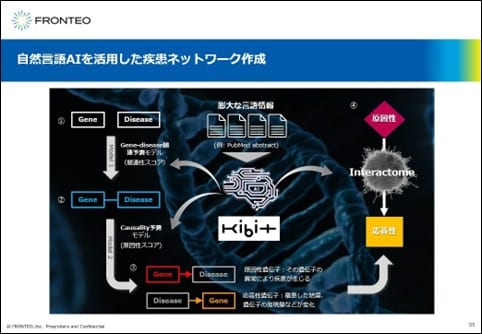
PubMed abstract約3000万報の言語情報をベクトルにしたものをベースとして構築した2つの予測モデルを用いて、ある疾患に関する原因性遺伝子と応答性遺伝子を決めます。そして、原因性遺伝子と応答性遺伝子とをインタラクトーム情報を用いて繋いで、ある疾患のネットワークを作成しています。
このシステムを用いますと、わずか10分で図に示すような疾患ネットワークを生成することができます。

ヒトの遺伝子は約2万3000ありますが、疾患に重要なパスウェイに限定した形でネットワークを作成しています。ネットワーク構成遺伝子数としては約500〜600、原因性遺伝子から応答性遺伝子までのパスウェイの長さが約8遺伝子以下、パスウェイ数としては約400個程度となります。このような形のネットワークを使用して、新しい分子の繋がりを発見することを進めています。

自然言語AIを活用すると、疾患名だけではなく、症状や薬剤名などの様々なネットワークを作成できることが特徴となります。
この疾患ネットワークのどこの部分が重要なのかは見ただけではわかりません。それを解決する手法が重複差分解析です。
重複差分解析
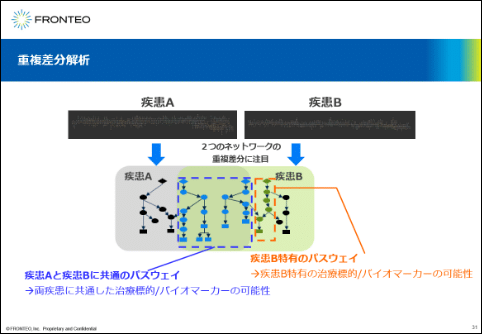
重複差分解析では、2つのネットワークの重複と差分に着目します。例えば、2つのネットワークの共通のパスウェイに着目すると、両疾患に共通した治療標的やバイオマーカーの可能性が浮かび上がります。また、差分に着目しますと、疾患Bに特有の治療標的やバイオマーカーに繋がる可能性のあるパスウェイがわかります。このように重複差分解析は、ある特徴的なパスウェイを浮かび上がらせることが可能な非常に強力なツールとなります。
Virtual Experiments
Virtual Experimentsは、注目した遺伝子をネットワーク上で仮想的にノックアウトする技術です。
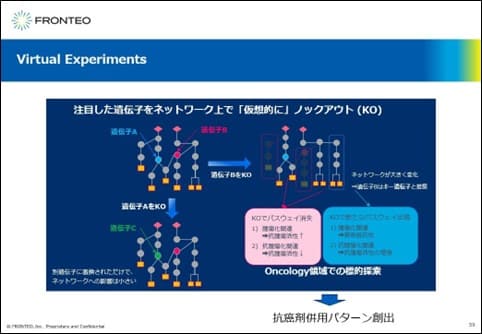
遺伝子Aや遺伝子Bに注目してこれらを仮想的にノックアウトしますと、AIはノックアウトした遺伝子Aの代わりに新たな遺伝子Cをネットワークに組み入れた結果を提示したり、あるいは、AIはノックアウトした遺伝子Bの下流パスウェイや全く離れたところのパスウェイを消失させたり、また、AIは新たなパスウェイを構築したりします。
例えば、AIが提示したこの結果をオンコロジー領域での標的探索で考えてみますと、遺伝子Bのノックアウト(KO)で消失したパスウェイが腫瘍化関連の場合、遺伝子Bは抗腫瘍活性がある良い標的と考えられます。一方、遺伝子BをKOした結果、腫瘍化関連のパスウェイが新たに構築された場合、抗がん剤抵抗性に繋がる可能性をパスウェイが提示している可能性があります。
今回の応用例では、この抗がん剤抵抗性の課題を取り上げて、Virtual Experimentsでの解決法をご紹介したいと思います。
Virtual Experiments ~AIはどんな結果を提示するか?~
Virtual KO:遺伝子ノックアウト
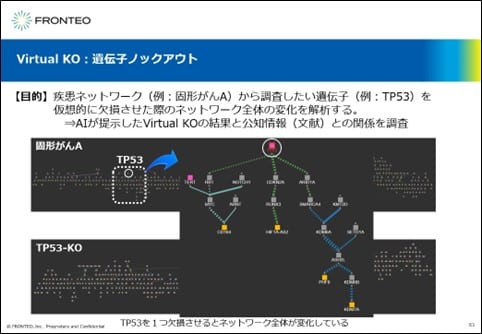
ここでは、固形がんAを例に、TP53を仮想的に欠損させた際のネットワークの変化に関して、AIが提示したVirtual Experimentsの結果と公知情報の関係を紹介します。
固形がんAのネットワークとTP53をKOした後のネットワークでは、大きな違いがあることがわかりますが、どのように変化したのかを詳細に見ていきたいと思います。
TP53-KO:TP53下流パスウェイの変化
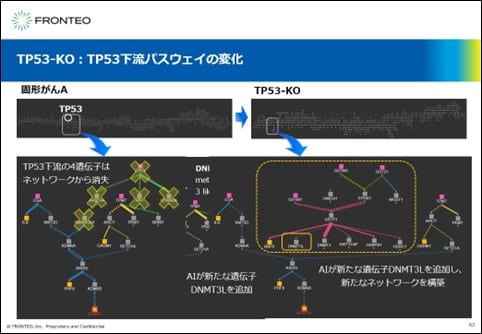
まず、TP53の下流のパスウェイがどのように変化したのかみていきます。TP53をノックアウトすると、TP53下流の4つの遺伝子がネットワークから消失し、AIはネットワーク上になかったDNMT3Lという新たな遺伝子を下流に追加させ、このような新たなネットワークを提示しました。
TP53下流以外のネットワークも変化
次に、TP53以外のネットワークを見てみます。
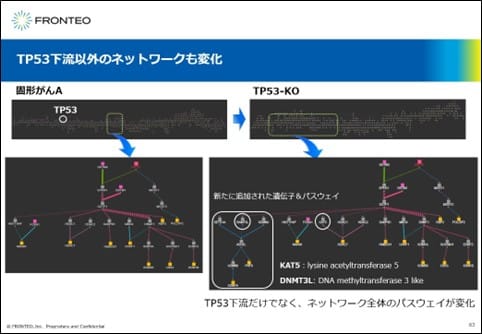
TP53-KOでは、点線枠部分のネットワークが大きくなっていることがわかります。AIは、新たな遺伝子あるいは パスウェイを追加して最終的にこのようなネットワーク全体を変化させた結果を提示しました。
TP53-KOネットワーク変化はp53ノックアウトマウスと合致
これはネットワークの全体の構成パスウェイの変化をまとめたものです。

固形がんAは464個のパスウェイからなり、TP53をノックアウトすると17個のパスウェイが消失し、新たに16個のパスウェイが生成されました。
青で示したDNMT3LがDNAメチル化、太字で示したものはヒストンのメチル化・脱メチル化、ヒストンのアセチル化・脱アセチル化に関連する遺伝子で、これらはエピジェネティック制御因子です。TP53をノックアウトすると、エピジェネティック制御異常が生じることをAIは提示していると考えられます。
これはp53のノックアウトにおいてDNAのメチル化が変化してエピジェネティックの制御異常が起きているという文献と合致しています。
Virtual KOで提示された結果を読み取る
こちらは、AIが提示したTP53下流の変化ですが、TP53のVirtual KOにより、AIは新たな遺伝子DNMT3LをTP53の経路に追加したことを説明しました。
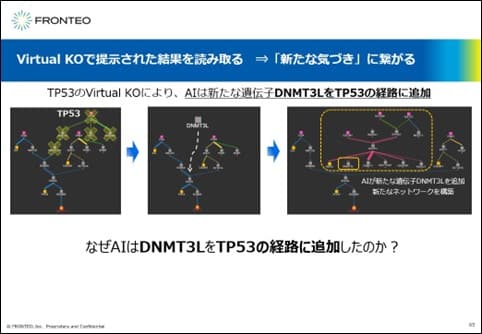
なぜAIは、TP53をノックアウトするとDNMT3Lという新たな遺伝子を経路に追加したのでしょうか?この部分をもう少し考察してみます。
応用例―抗がん剤抵抗性
新たな気づきに繋がる
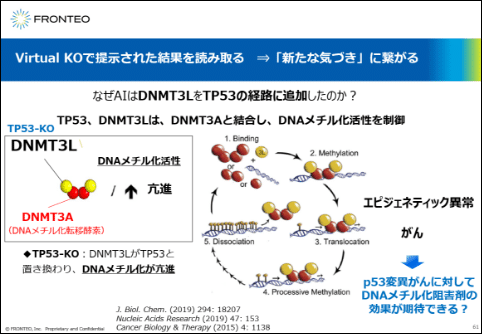
文献を調べますと、TP53とDNMT3Lは、 DNAメチル化活性を有するDNMT3Aという分子に結合してDNAのメチル化活性を制御していると報告されています。
TP53の存在下では、結合力が強いTP53がDNMT3Lと結合してDNAメチル化の活性を抑制する方向に制御していますが、TP53が変異あるいは欠損した状況では代わりにDNMT3LがDNMT3Aと結合できるようになり、今度は逆にDNAのメチル化活性が亢進する方向にシフトして、エピジェネティックの異常が生じてがんになってしまうとAIが提示していると考えられます。
そうすると、p53の変異がんに対しては、このDNAメチル化活性をうまく阻害することができれば抗腫瘍効果が期待できるのではないかと予測されます。
Virtual KOが提示する結果は創薬標的・バイオマーカーのヒントになる
こちらに関しては、興味深い論文が出ています。
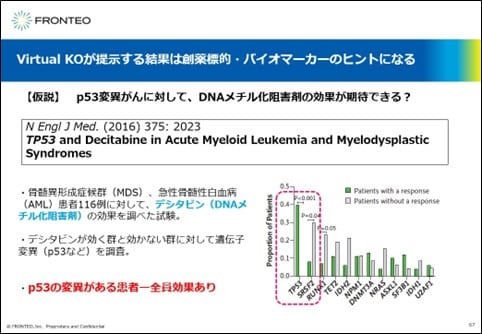
骨髄異形成症候群、急性骨髄性白血病の患者116例に対して、DNAメチル化阻害剤であるデシタビンの効果を調べた試験です。デシタビンが効く群と効かない群に対して遺伝子変異などを調査したところ、興味深いことにTP53の変異がある患者は全員DNAメチル化阻害剤の効果があったという結果が出ています。
このように、AIが提示する結果を詳細に解析していくと、創薬標的やバイオマーカーのヒントに繋がることがご理解いただけたかと思います。
抗がん剤抵抗性
最後に、応用例として抗がん剤の抵抗性の話に移りたいと思います。
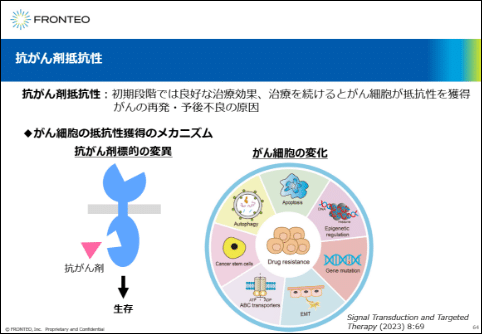
抗がん剤としては、最近では分子標的薬など非常に効きの良い薬が出てきていますが、初期段階では良好な治療効果を示しても、治療を続けるとがん細胞が抵抗性を獲得して再発や予後不良の原因になるという課題があります。
がん細胞の抵抗性獲得のメカニズムとして、抗がん剤の標的の変異があります。作用する部位やポケットの構造が変化してしまい、抗がん剤が作用できなくなってしまうという状況になります。
これは標的部位が違う抗がん剤を使うことで回避できると考えられますが、厄介なのはがん細胞がどんどん性質を変化させて抗がん剤の抵抗性を獲得している場合で、非常に難しい問題になります。
エピジェネティックやApoptosis、Autophagy、がんの幹細胞化やABC transporters、EMTといった変化が報告されています。
我々のVirtual Experimentsでは、このようながん細胞の変化を予測できる可能性があり、本方法を利用して抗がん剤抵抗性に対する新たな治療標的候補を探索した事例を紹介したいと思います。
Virtual KO:乳がんーERBB2(Her2)をノックアウト
今回は、乳がんのERBB2(HER2)を標的した場合について説明します。

こちらはbreast cancerのネットワークです。 ERBB2のVirtual KOを行うと、パスウェイが15個消失しました。AIが提示したこの2つのパスウェイ(TRIM28、CENP1)は、抗腫瘍活性に繋がる経路だと考えられます。一方、 新たなパスウェイが25個出現しました。こちらの2つ(DUSP16、ケモカインシグナル)は治療抵抗性に繋がるパスウェイであり、ERBB2を阻害すると、がん細胞はこれら2つのパスウェイを出現させて抗がん剤に対する抵抗性を獲得するとAIは予測しました。
抗がん剤抵抗性の治療標的の予測

このAIが提示した2つの抗がん剤抵抗性に繋がるパスウェイ(DUSP16、ケモカインシグナル)は、抗がん剤抵抗性の予測指標と考えることができます。
抗がん剤抵抗性に対しては、抗がん剤を2つ併用する治療アプローチがあります。ERBB2に加えてもうひとつの遺伝子Xをノックアウトすることで、抗がん剤抵抗性に関する2つの予測指標を消失させることができれば、Xは抗がん剤抵抗性に対する新たな治療標的になると考えられます。
予測指標下側のパスウェイ中にある遺伝子CXCL8をノックアウトすると、ケモカインパスウェイが消失できると考えて、ERBB2とCXCL8のダブルのVirtual KOを実施したところ、AIはIL6から新たなケモカインシグナルを多数発生させて、さらに悪くなる状態を提示してきました。この2つの抗がん剤の抵抗性の指標を消すことは、なかなか難しい問題です。
がん細胞は抗がん剤刺激に応じてパスウェイ経路を変化
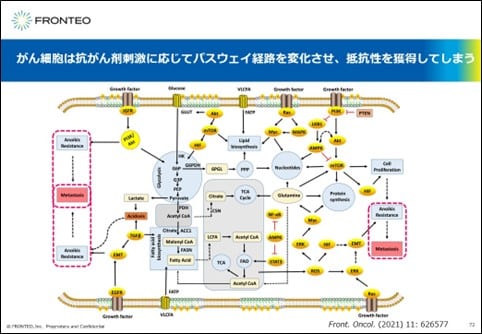
こちらの論文では、がん細胞は抗がん剤の刺激に応じて巧みにパスウェイの経路を変化させて抵抗性を獲得してしまうことが報告されています。
先ほど示したVirtual Experimentsのように、AIは色々な抗がん剤抵抗性に関する予測、がん細胞で生じているこのような変化を提示していると考えています。
このようなダブルノックアウトの実験を細胞レベル、動物レベルでしようとすると、非常に多大な労力とコストがかかりますが、Virtual Experimentsでは簡単にできます。
Virtual 2KOー抗がん剤抵抗性創薬標的combinationスクリーニング
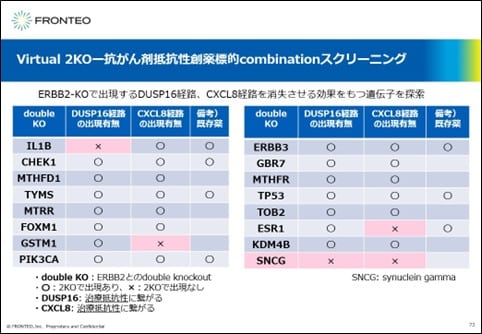
こちらは、 ERBB2でノックアウトして出現する2つの経路を消失させる効果を持つ遺伝子をVirtual Experimentsで探索した結果です。抗がん剤の予測指標である経路が消失した場合は×、 経路が出現した場合は○で示しています。
既存薬がある遺伝子で2つのパスウェイを消すことができると非常に後の実験はやりやすいのですが、色々試しても2つの指標を消せる効果を持つ遺伝子はなかなか見つかりませんでした。
最後に示しているSNCGがパーキンソン病などで有名なsynuclein gammaですが、AIはこの遺伝子をERBB2とダブルでノックアウトすると2つのパスウェイを消去できると提示しました。
自然言語AIの特徴を活かした抗がん剤抵抗性に関与する標的分子の探索
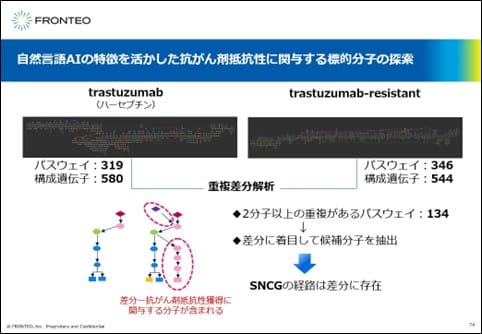
このような新たな抗がん剤抵抗性に関する標的分子の探索を、別の手法でも行ってみました。この自然言語AIでは、疾患だけでなく治療薬の名前でも疾患ネットワークを構築できると最初にお話ししました。ここではHER2を標的とした治療薬であるハーセプチンと、そのresistantを付けた抵抗性に関する2つのネットワークを作成しました。2つのネットワークは違っていますが、重複差分解析を実施すると差分に抗がん剤抵抗性に関する分子が含まれると予想できます。実際に重複差分解析を実施して候補分子を抽出すると、先ほど示したSNCGが差分に存在していることがわかりました。このsynuclein ganmaに関しては、がんが進行すると増加するという興味深い報告があり、これからもう少し詳細に調べていきたいと考えています。
まとめ

まとめになります。AIが提示するVirtualノックアウトの結果は、過去に蓄積された知見からの予測を提示していると考えられ、AIが提示するネットワーク変化を注意深く考察することにより、新たな創薬標的に繋がる仮説 を作り出すことが可能となります。
抗がん剤抵抗性は困難な課題ですが、Virtualノックアウトが提示する予測指標を活用することにより、抗がん剤抵抗性の治療に繋がる新たな創薬標的combinationを探索できる可能性があります。












